药物的安全性评价须严格遵循预定的试验方案执行,而该方案的设计需根据试验药物临床前、已完成临床试验(如有)或同靶点药物安全性信息,预先设定安全性评估的具体内容和时间安排。
安全性评估内容主要包括参与者用药前后以及不同随访时间点所收集的AE、体格检查记录、生命体征监测、实验室检查结果以及PK数据等。
对于药物相关常见的AE,在试验开展前拟定相应的临床治疗原则及停药原则,有助于规范参与者的安全管理流程,提升临床试验的安全性和科学性。前期我们提到AE的临床治疗原则及停药原则需研究者结合药物作用机制、安全性风险信息、试验入选人群特征评估后确定,那么不同于小分子化药的常见AE,生物大分子药物常见AE的临床治疗原则及停药原则又该如何考量呢?
生物大分子药物(包括单克隆抗体和其他治疗性蛋白制剂等)与生物大分子药物的主要区别在于分子大小、结构复杂性和生产方式。生物大分子药物本身具有生物活性,因此其毒性作用通常与药效相关,且脱靶效应较为少见。生物大分子药物常见的AE有免疫原性、免疫相关不良事件(immune-related adverse event,irAE)、输液相关反应(infusion related reaction,IRR)、注射部位反应(injection site reactions,ISR)及其他。常见心脏毒性(QT间期延长、心律失常、心肌和心脏瓣膜损伤、血压影响)、肝脏毒性、肾脏毒性。相关作用机制及常见药物见下表:
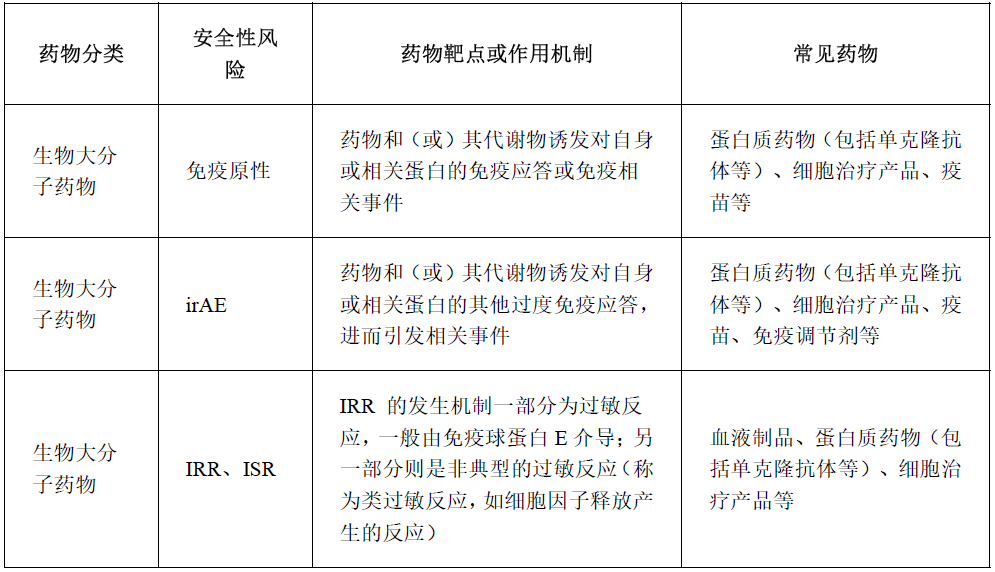
这些生物大分子药物治疗原则及停药原则根据AE的不同,采取的常见措施如下:
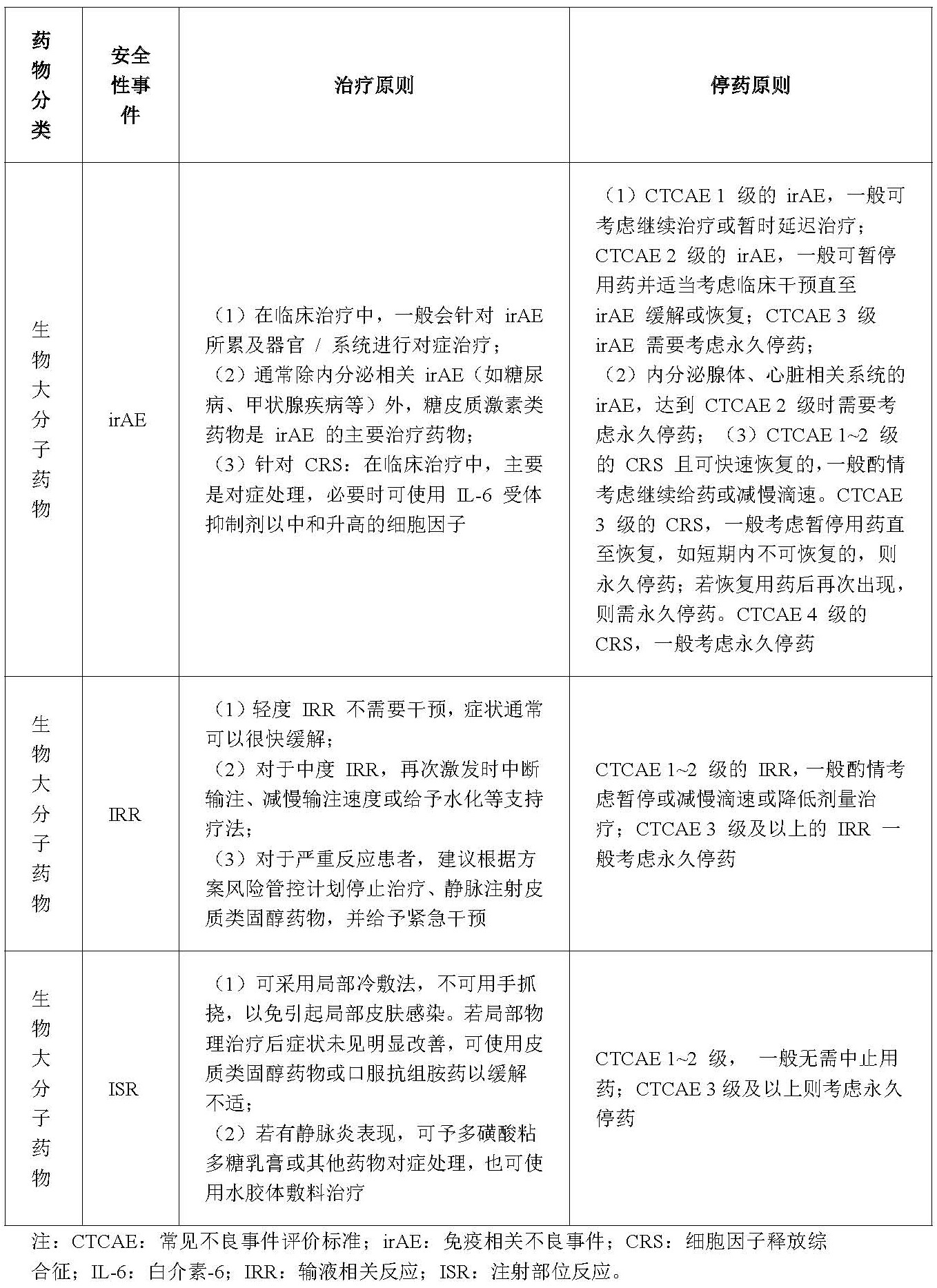
总而言之,一般相关AE的处理原则和治疗方案均会体现在临床试验方案中,通常会结合AE的严重程度、累及器官/系统以及持续时间来综合考虑。方案实施的安全性风险管控直接关系到参与者的生命安全以及试验的合规性。建立完善的安全性风险管控体系,是确保参与者权益、提高试验质量和推动新药研发的重要基础。
参考文献:
1、Ⅰ期临床试验中健康参与者安全性管理的专家共识
2、药物临床试验期间安全信息评估与管理规范
供稿 / 医学部 张梦
|