临床试验是评价药物安全性和有效性的重要手段,是药品审批上市的重要依据[1]。方案偏离(protocol deviation,PD)是指未能遵循临床试验方案,或违背人体受试者保护规定及伦理委员会要求开展实施临床试验的情况[2]。在临床试验实施过程中,研究者应尽量避免或减少方案偏离的发生[3]。
PD按发生的责任主体可分为:
1)研究者/研究机构不依从的PD;
2)受试者不依从的PD;
3)申办者方面的不依从的PD。
PD按严重程度分:
1)重要(严重)方案偏离:指严重影响受试者权益、安全和健康或者临床试验科学性;
2)轻微方案偏离:未被定义为重要方案偏离,目前对数据质量和完整性无影响/可忽略的影响,但同类多次发生时需要进行重新评估,有可能会分类为重要方案偏离。
注意:重要PD一般需要在临床总结报告中进行报告,而轻微PD可以不在临床总结报告中报告。另外,轻度或重度偏离法规上没有明确的规定,可按照试验方案规定、申办者/CRO/研究机构SOP执行。
根据方案偏离涉及的内容不同,
常见的方案偏离可以大致分为以下几种情况:
检查/检验缺失
检查/检验缺失是指受试者未按方案要求进行相应的检查、检验,是最常见的PD。此类PD的严重程度视方案而定。如某慢性阻塞性肺病项目需要排除结核阳性患者,受试者未进行结核检验就已入组并用药,补测后若发现患者结核检验结果为阳性,则属于重大PD。如果为常规实验室检测,那么缺失的检查/检验不影响受试者入组、排除及随机分层等情况,则属于常规PD。
导致此类 PD 的可能的原因:
(1)受试者原因:
患者在进行大便常规检查时未按要求操作,致使某些结果未检出。
(2)研究者原因:
①研究者对方案不熟悉,漏开了相应的检查/检验;
②研究者开具了相关的检查/检验,研究护士也按方案采样,但送样时漏送,导致某结果缺失。
(3)其他原因:
血生化和血糖原本只需要1份血样即可出具血生化和血糖检测结果,后因检验科更新系统,血生化检测和空腹血糖检测需要采集2管血样送检,但专业科室只采血1份,导致血糖结果缺失。
访视缺失
访视缺失是指受试者未按照试验方案要求来院随访,此类PD的严重程度视方案而定。若此次访视需要检查/检验的某些关键指标涉及受试者中止或退出临床 试验、二次随机用药等,则属于重大PD。如某卵巢癌项目需要在用药6个周期后进行二次随机分组,若此次受试者访视缺失就属于重大PD。
导致此类 PD 的可能的原因:
(1)受试者原因:
患者因自身原因不能按时来院随访。
(2)研究者原因:
研究者工作疏漏致受试者访视缺失。
(3)其他原因:
受外界不可抗力的影响,如受疫情影响,部分受试者因所处地区疫情管控封锁,不能按照窗口期时间来院随访。
访视超窗
访视超窗是指受试者未按照试验方案要求的时间返院,是较为常见的PD。
导致此类PD的主要原因:
(1)受试者原因:
患者因自身原因不能按时来院随访。
(2)其他原因:
受疫情等外界不可抗力的影响,不能按照窗口期时间来院随访。
检查/检验超窗
检查/检验超窗是指受试者检查、检验结果超过试验方案规定的窗口期。
导致此类PD的主要原因:
(1)受试者原因:
因受试者访视超窗,导致规定的检查/检验不能按时完成。
(2)研究者原因:
①研究者对试验方案不熟悉,漏开了相应的检查/检验;
②受试者虽然在入组前做过相关检查/检验,但超过了入组规定的期限,研究者出于对受试者安全性及伦理的考虑,决定直接采用已有的结果。
试验药物使用及剂量
导致此类PD的主要原因:
(1)受试者原因:
未按试验方案规定的剂量使用药物,出现药物漏服、多服的情况。
(2)研究者原因:
研究者对方案不熟悉。例如方案规定,患者出现某种不良事件(adverse event,AE)且严重程度分级为 4 级时,需要停用药物,但研究者仍开具试验药物并给患者使用;又如方案规定,连续停用药物2次以上的受试者应退出研究,但研究者在实际过程中未通知受试者出组;再如方案规定,试验过程中试验药物的剂量只能下调,但研究者在受试者AE改善后却将药物剂量调整为原始剂量。
药品超温/温度缺失
导致此类PD的主要原因:
(1)研究者原因:
药品管理员取药时打开冰箱的时间过长。
(2)其他原因:
温度计损坏导致某时段温度缺失。
生物样本采集和处理
生物样本采集和处理为临床试验的关键环节,其采集和处理的规范性直接影响临床试验的主要、次要疗效指标结果的准确性,进而影响受试者的安全性。此类PD主要包括样本离心时间过长、静置时间不符合要求、采集时间超窗、采集点漏采、超温等。
导致此类PD的主要原因:
(1)研究者原因:
①研究者安排受试者随访时没有考虑样本采集护士的排班情况,将多个受试者的随访时间安排为同一天的同一时段,导致生物样本采集超窗;
②授权的研究护士、临床研究协调员(clinical research coordinator,CRC)等对生物样本采集相关标准操作规程(standard operating procedure,SOP)及操作手册不熟悉,导致生物样本采集超窗、采集点漏采。
(2)其他原因:
样本采集后,贮藏过程中超温。
使用违禁药
使用违禁药是指受试者在组期间,使用试验方案中明确禁止的药物,属于重大 PD。
导致此类PD的主要原因:
(1)受试者原因:
受试者在其他科室或外院复诊,复诊医师按照诊疗常规开具相关药物。
(2)研究者原因:
研究者对试验方案不熟悉,对违禁药的范围不清楚,故开具了相关药物。
知情同意书签署
知情同意书签署应严格按照GCP及试验方案执行,新版本知情同意书经过伦理审查后,研究者应及时让在组受试者签署,筛选失败的受试者所签署的知情同意书也应保留在受试者文件夹中。
导致此类PD出现的原因均与研究者有关:
(1)研究者丢失了筛选失败的受试者所签署的知情同意书原件,仅留存了扫描件。
(2)新版本知情同意书经过伦理审查后,研究者未及时与受试者签署。
误纳
误纳是指受试者在不符合入组标准或者符合排除标准的条件下,被研究者错误地纳入某项研究的情况。此类PD相对较少,但严重程度高,属于重大PD。
导致此类 PD 的原因主要与研究者相关:
(1)研究者对试验方案不够熟悉,审核入组时不够仔细。
(2)患者的外院病历在本院系统中无法查询,研究者在询问患者病史时不够仔细,导致入组后才发现受试者违背了纳入标准。
PD上报
PD的上报主要分为日常状态和定期上报,日常状态又需要根据偏离严重程度进行:

解决措施
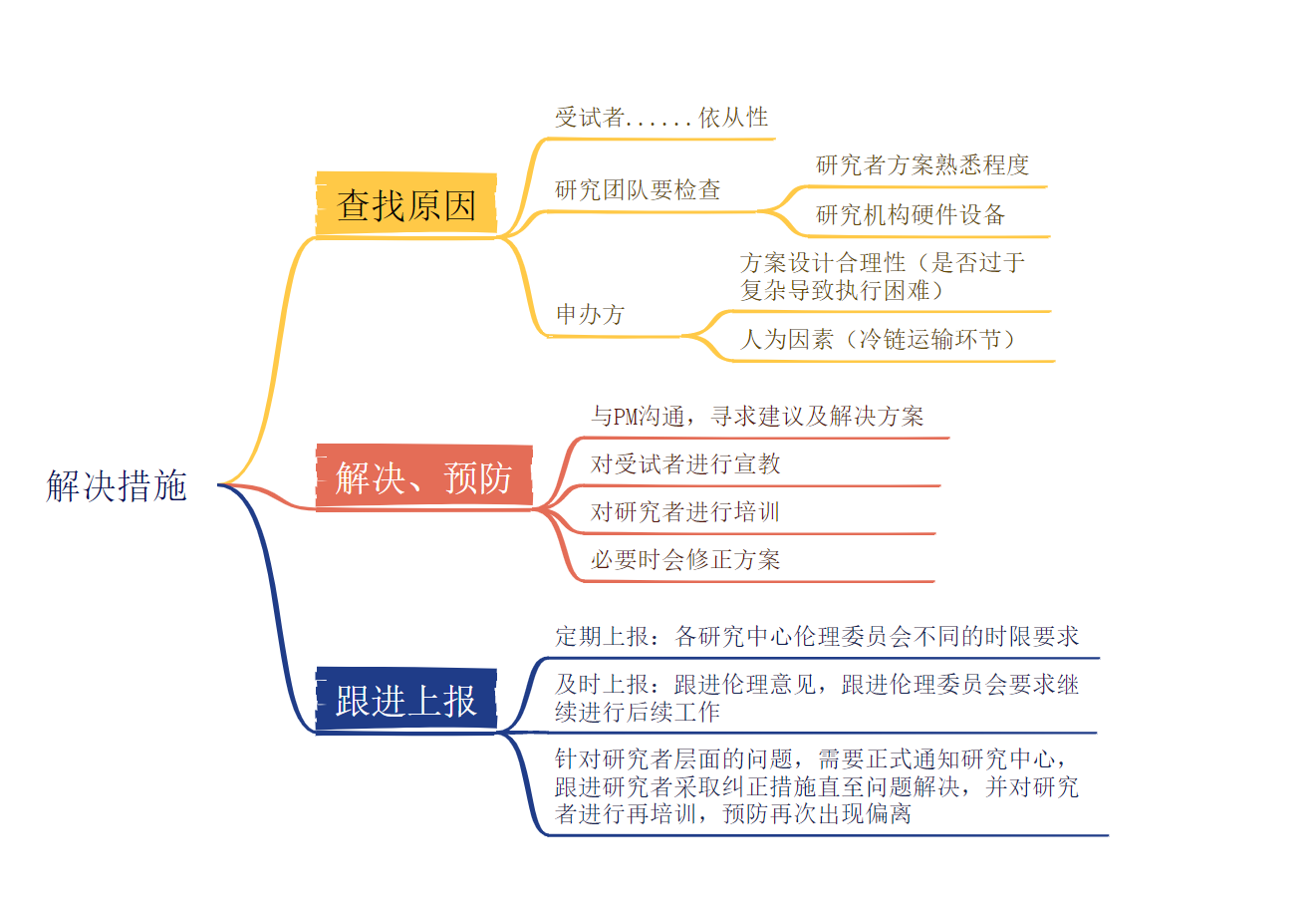
试验方案偏离的处理流程
试验方案偏离的处理应该遵照企业的标准操作规程而执行。
1、在启动阶段,主要数据管理人员撰写方案偏离的处理计划(handling plan of protocol deviation)。方案偏离的处理计划应对方案偏离进行明确定义,制定严重违背及轻度方案偏离的判断标准,同时对方案偏离的跟踪和管理进行明确规定。
2、计划的草案完成后交由相关人员进行审核。
3、收到审核意见以后,召集包括项目主管、主要数据管理人员、临床监查员、临床编程员、数据管理人员、医学事务专员在内的方案偏离的处理计划审核会,讨论各方意见,在数据库存上线前应该完成方案偏离的处理计划的批准和签字。
4、在临床试验中,试验方案如有更新,应该根据方案内容更新,及时地更新方案偏离的处理计划,但在数据库锁库前必须最终定稿。
PD可被临床监查员、数据管理人员和临床编程员从不同的来源检出,计划书中也应对不同来源PD的检出方法和对策进行规定。
在方案偏离的处理计划中应对PD报告/审核的频度进行规定。所有检出的PD应该被记录在PD报告中,详细记录发现的时间、事件发生的时间及过程、原因及相应的处理措施。对于严重的PD应该报告给药监局和伦理委员会,所以在计划书中应该就有关PD给药监局和伦理委员会的报告流程加以详细描述。
方案偏离的处理计划中还需对盲态研究的PD管理进行详细描述。当项目有非盲态团队时,盲态和非盲态的PD清单应该分别被产生保存,而非盲态清单不应该和盲态清单在一起被送给所有项目组成员审核,由非盲态组人员专门审核PD的非盲态清单。
参考文献:
[1]刘英,漆璐,佟媛旭等. 全过程质量控制在Ⅰ期临床试验管理中的应用[J]. 中国新药杂志,2021,30(3):254-258.
[2]叶丽君,蔡淑帆,林能明等.某院抗肿瘤药物临床试验方案偏离的回顾性研究[J]. 医药导报,2021,40(12):1761-1765.
[3]谢江川,谢林利,曹丽亚等.药物临床试验中常见方案偏离及改进措施[J]. 中国药房,2022,33(13):1554-1558.
[4]谢江川, 谢林利等.药物临床试验中常见方案偏离及改进措施.中国药房2022年第33卷第13期
[5]李灿霞,黄丽凤,雷雨燕等.生物等效性试验各阶段易忽视问题与改进措施[J].中国医药科学,2020,10(20):234-236,240.
[6]李树,赵氚,成程等.临床试验中违背方案问题的分析与建议[J]. 中国医学伦理学,2021,34(2):211-215.
[7]刘金华,刘敏,刘雨村等.我院药物临床试验实施中方案偏离的回顾性研究[J].中国药房,2017,28(25):3474-3478.
供稿 / 医学部 李梅
|